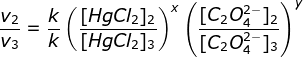SDFGDZXGDZXGS
Rangkuman Materi Laju Reaksi Kelas 11
Pengertian Laju Reaksi
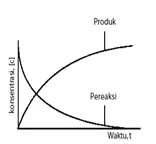
Menunjukkan perubahan konsentrasi zat yang terlibat dalam reaksi setiap satuan waktu.
pA + qB → rC + sD
Pereaksi Hasil reaksi
(Konsentrasi berkurang) (Konsentrasi bertambah)
Rumusan laju reaksi
- Untuk pereaksi:
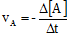
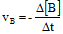
Tanda (-) berarti berkurang
- Untuk produk:
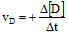
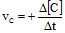
Tanda (+) berarti bertambah
Hubungan Laju Reaksi dan Koefisien Reaksi
Laju reaksi suatu zat berbading lurus dengan perbandingan koefisien reaksi zat tersebut
pA + qB → rC + sD
vA : vB : vC : vD = p : q : r : s
Persamaan Laju Reaksi
Menunjukan hubungan antara laju reaksi dengan konsentrasi pereaksi yang terlibat dalam reaksi. Hanya dapat ditentukan dari data hasil percobaan. Jika diketahui persamaan reaksi:
pA + qB → rC + sD
maka persamaan laju reaksinya:
v = k [A]x [B]y
v = laju reaksi ; k = konstanta laju reaksi
[A] = konsntrasi zat A (M) ; [B] = konsentrasi zat B (M)
x = orde reaksi zat A ; y = orde reaksi zat B
x+y = orde total reaksi.
Orde reaksi
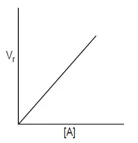
- Reaksi Orde nol (v = k [A]0)
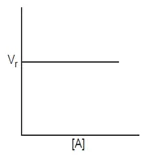
- Reaksi Orde satu (v = k [A])
- Reaksi Orde dua (v = k [A] [B] atau v = k [A]2)
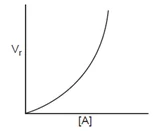
Faktor-faktor yang mempengaruhi laju reaksi
Konsentrasi pereaksi
Semakin besar konsentrasi pereaksi, semakin cepat reaksi berlangsung/laju reaksi semakin besar. Karena semakin banyak zat yang bertumbukan.
Suhu
Semakin besar suhu reaksi, semakin cepat reaksi berlangsung/laju reaksi semakin besar. Karena energi kinetik zat yang bereaksi akan semakin besar untuk bertumbukan
Luas permukaan
Luas permukaan adalah besarnya permukaan yang dapat disentuh ketika bereaksi. Semakin besar luas permukaan, semakin cepat reaksi berlangsung/laju reaksi semakin besar.
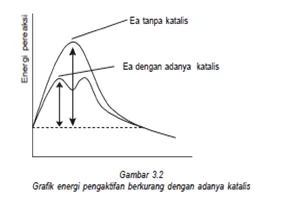
Katalis
Katalis adalah zat yang ditambahkan untuk mempercepat reaksi dengan jalan mencari tahap dengan energi aktifasi yang lebih rendah. Katalis tidak ikut bereaksi karena di produk akan terbentuk kembali. Jenis katalis ada yang homogen ( wujud katalis dengan pereaksi sama) ada yang heterogen (wujud katalis dengan pereaksi berbeda).
Hubungan Kenaikan Suhu Terhadap Laju Reaksi
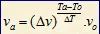
atau
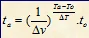
Va = laju reaksi pada suhu akhir (M/s)
Vo = laju reaksi pada suhu awal (M/s)
Ta = suhu akhir (oC)
To = suhu awal (oC)
Dv = kenaikan laju reaksi
DT = kenaikan suhu
ta = lama reaksi pada suhu akhir (s)
to = lama reaksi pada suhu akhir (s)
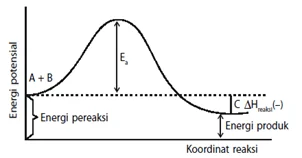
Teori tumbukan
- Agar dapat bereaksi partikel-partikel peraksi harus saling bertumbukan yang dipengaruhi oleh arah tumbukan dan frekuensi tumbukan .
- Energi aktifasi (Ea) adalah energi kinetik minimum yang harus dimiliki oleh partikel pereaksi agar dapat bereaksi membentuk kompleks teraktivasi.
Soal Essay Laju Reaksi
Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi ?
PEMBAHASAN :
Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu. Satuannya dinyatakan sebagai mol dm-3 det-1 atau mol/liter detik
Zn(s) + 2HCI(aq) → ZnCI2 (aq) + H2(g)
Bagaimanakah rancangan percobaan yang akan Anda buat terkait dengan :
a. Zat yang akan diukur konsentrasinya.
b. Cara pengukurnya.
c. Alat yang digunakan.
d. Cara kerjanya.
PEMBAHASAN :
a. Zat yang akan diukur konsentrasinya yaitu gas H2
b. Cara mengukurnya dengan menghitung volume H2 yang dihasilkan per satuan waktu
c. alat yang digunakan untuk mengukur volume H2 yaitu silinder ukur yang dicelupkan ke dalam gelas kimia berisi air
d. Gas yang dihasilkan yaitu gas H2 akan mengisi ruang di silinder ukur yang berisi air yang kemudian menyebabkan adanya ruang kosong yang diukur volumenya.
N2(g) + 3H2(g) → 2NH3(g)
Setelah reaksi berlangsung selama 5 detik, ternyata masih tersisa 0,08 mol gas N2.
Tentukan laju reaksi sesaat berdasarkan:
Persamaan reaksi:
m 0,1 0,1 –
r 0,02 0,06 – 0,04 +
s 0,08 0,04 0,04
Tentukan :
a. Laju reaksi rata-rata dari gas A pada setiap selang waktu.
b. Laju reaksi rata-rata setiap selang waktu berdasarkan gas AB3 yang dihasilkan.
a. Selang waktu 0-5 detik
b. Selang waktu 0-5 detik
![]()
a. Berkurangnya gas NO2 tiap detik.
b. Bertambahnya gas N2O5 tiap detik.
PEMBAHASAN :
menentukan laju reaksi suatu zat dapat diperoleh dengan membandingkan koefisien dengan zat yang sudah diketahui laju reaksinya
a. ![]()
b. ![]()
PEMBAHASAN :
Persamaan laju reaksi yaitu persamaan yang menunjukan hubungan antara konsentrasi pereaksi dengan laju reaksi
PEMBAHASAN :
1. tidak bisa menentukan konsentrasi pereaksi saat reaksi sedang berjalan
2. ada kemungkinan reaksi berbalik arah, yaitu zat hasil reaksi kembali menjadi pereaksi
PEMBAHASAN :
Persamaan laju reaksinya v = k[A]0 atau v = k
satuan tetapan laju reaksinya yaitu mol/L detik atau M/s
NH4+(aq) + NO2--(aq) → N2(g) + 2H2O(l)
Adalah v = k [NH4+] [NO2--]. Pada suhu 25°C, nilai k = 3,0 x 10-4 mol-1 L detik-1.
Hitunglah laju reaksinya jika [NH4+] = 0,25 M dan [NO2--] = 0,02 M.
PEMBAHASAN :
v = k [NH4+] [NO2--]
v = 3,0 x 10-4 x 0,25 M x 0,02 M = 1,5 x 10-6 M/s
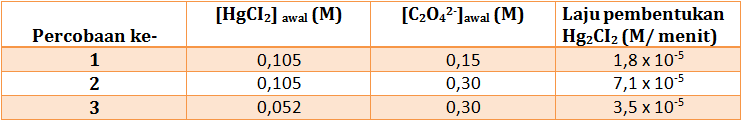
a. Dari data tersebut, tentukan orde reaksi terhadap HgCI2 dan C2O42- , serta orde reaksi keseluruhan.
b. Hitung nilai tetapan laju reaksinya (k).
c. Hitung laju reaksi jika konsentrasi awal HgCI2 0,02 mol/L dan C2O42- 0,22 mol/L.
a. menentukan orde HgCI2 (Cari 2 [C2O42-] yang sama yaitu percobaan 2 & 3)
Bandingkan percobaan 1 & 2
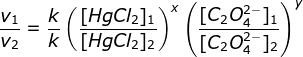
(karena k dan HgCI2 sama maka bisa dicoret)
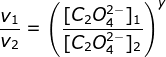
![]()
![]()
y = 2
Orde totalnya = x + y = 1 + 2 = 3
v = k [HgCl2]1[C2O42-]2 = 7,62 x 10-3 x (0,02)1 x (0,22)2 = 7,37 x 10-6 M/menit
PEMBAHASAN :
Faktor yang mempengaruhi laju reaksi diantaranya:
a. Luas permukaan
b. Konsentrasi pereaksi
c. Suhu
d. Katalis
PEMBAHASAN :
Semakin besar konsentrasi pereaksi, semakin besar jumlah partikel sehingga banyak peluang terjadinya tumbukan. Sehingga semakin banyak tumbukan, laju reaksinya semakin cepat
PEMBAHASAN :
akan lebih cepat dengan uap air, karena uap air memiliki luas permukaan yang lebih besar dibanding es atau air. Jika dengan uap air akan semakin banyak partikel yang bersentuhan dengan besi
PEMBAHASAN :
Jika suhu dinaikan, maka partikel akan bergerak lebih cepat yang menyebabkan energi kinetik partikel meningkat yang dapat menghasilkan tumbukan yang semakin sering sehingga laju reaksinya akan semakin cepat
PEMBAHASAN :
diketahui:
kenaikan laju reaksi (n) = 2
kenaikan suhu (ΔT) = 10°C
T1 = 20°C
T2 = 40°C
t20 = 30 menit
![]()
![]()
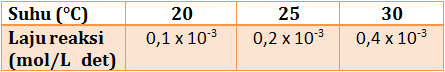
Berdasarkan tabel tersebut, perkirakan laju reaksi pada 5°C dan 50°C.
PEMBAHASAN :
diketahui:
kenaikan laju reaksi (n) = 2 ( dari suhu 20°C ke 25°C)
kenaikan suhu (ΔT) = 5°C ( dari suhu 20°C ke 25°C)
v20 = 0,1 x 10-3 menit
Menentukan laju reaksi pada 5°C jika dibandingkan laju reaksi pada suhu 20°C
T1 = 5°C
T2 = 20°C
![]()
![]()
![]()
Menentukan laju reaksi pada 50°C jika dibandingkan laju reaksi pada suhu 20°C
T1 = 20°C
T2 = 50°C
![]()
![]()
PEMBAHASAN :
Energi aktivasi yaitu energi minimal yang diperlukan untuk berlangsungnya suatu reaksi, katalis adalah suatu zat yang dapat mempercepat laju reaksi, tetapi tidak mengalami perubahan yang kekal. Hubungan antara katalis dan energi aktivitas dengan adanya katalis reaksi dapat menurunkan energi aktivasi
PEMBAHASAN :
dengan adanya katalis reaksi dapat lebih cepat dengan cara mengubah jalannya reaksi, dimana jalur reaksi yang ditempuh memiliki energi aktivasi yang lebih rendah
PEMBAHASAN :
Beberapa faktor yang mempengaruhi tumbuhan efektif kemungkinan tidak terpenuhi, seperti energi yang diperlukan untuk berlangsungnya reaksi kurang
PEMBAHASAN :
Pada pembuatan resin sering ditambahkan katalis untuk mempercepat terjadinya pembekuan resin.
Sumber Soal : Kimia Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
Soal Ulangan Pilihan Ganda (PG) Laju Reaksi
- berkurangnya konsentrasi A per satuan waktu
- berkurangnya konsetrasi C per satuan waktu
- bertambahnya konsentrasi B per satuan waktu
- bertambahnya konsentrasi A dan B per satuan waktu
- berkurangnya konsetrasi C dan D per satuan waktu
PEMBAHASAN :
Laju reaksi merupakan berkurangnya konsentrasi pereaksi per satuan waktu atau bertambahnya konsentrasi produk per satuan waktu. A dan B merupakan pereaksi sedangkan C dan D merupakan produk. Sehingga ungkapan yang tepat adalah berkurangnya konsentrasi A atau B per satuan waktu atau bertambahnya konsentrasi C dan D per satuan waktu. Sehingga jawaban yang paling tepat adalah A
Jawaban A
- 10-2 M det-1
- 3 x 10-2 M det-1
- 3 x 1-3 M det-1
- 4 x 10-3 M det-1
- 10-3 M det-1
PEMBAHASAN :
Menentukan laju fosgen dapat ditentukan dari rumus:
![]()
![]()
Jawaban C
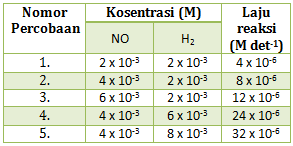
2NO(g) +2H2(g) → N2(g) + 2H2O(g)
diperoleh data percobaan sebaga berikut :
- V = k[NO][H2]
- V = k[NO]2[H2]
- V = k[NO]
- v = k[NO][H2]2
- v =k[H2]
PEMBAHASAN :
Menentukan persamaan laju reaksi harus menentukan orde reaksinya terlebih dahulu
Menentukan orde NO : cari 2 [H2] yang sama (percobaan 1 dan 2)
![]()
![]()
![]()
x = 1
Menentukan orde H2 : cari 2 [NO] yang sama (percobaan 2 dan 4)
![]()
![]()
![]()
y = 1
maka persamaan laju reaksinya adalah v = k[NO][H2]
Jawaban A
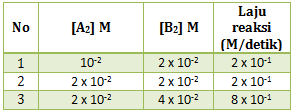
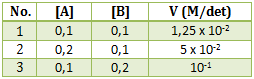
Perhatikan data percobaan dari reaksi berikut :
- 5 x 102
- 5 x 10-3
- 5 x 104
- 1,25 x 10-2
- 1,25 x 102
PEMBAHASAN :
Untuk menentukan k maka terlebih dahulu menentukan orde masing-masing pereaksi
Menentukan orde A : cari 2 [B] yang sama (percobaan 1 dan 2)
![]()
![]()
![]()
x = 0
Menentukan orde B : cari 2 [A] yang sama (percobaan 2 dan 3)
![]()
![]()
![]()
y = 2
maka persamaan laju reaksinya adalah v = k[B]2
Untuk menentukan k masukan ke salah satu percobaan (ambil percobaan 1)
v1 = k [B]1
![]()
Jawaban A
- Sama seperti semula
- Lebih besar 2 kali
- Lebih kecil 2 kali
- Lebih kecil 4 kali
- Lebih besar 4 kali
PEMBAHASAN :
Konsentrasi NO tidak akan mempengaruhi laju reaksi karena memiliki orde nol atau tidak ada dalam persamaan laju reaksi. Sedangkan jika konsentrasi Br dinaikan 2 kali maka laju reaksi menjadi:
![]()
v2 = 4v1
Laju reaksi yang baru lebih besar 4 kali dari laju reaksi semula
Jawaban E
A + B → C + D
- 0
- 1/2
- 1
- 2
- 3
PEMBAHASAN :
Untuk menentukan orde total maka terlebih dahulu menentukan orde masing-masing pereaksi
Menentukan orde A : cari 2 [B] yang sama (percobaan 1 dan 2)
![]()
![]()
![]()
x = 1
Menentukan orde B : cari 2 [A] yang sama (percobaan 4 dan 5)
![]()
![]()
![]()
y = 0
maka orde totalnya adalah x + y = 1 + 0 = 1
Jawaban C
Setiap kenaikan suhu 10◦C, laju reaksi menjadi dua kali lebih cepat dari semula. Jika pada suhu 20◦C laju reaksi berlangsung 8 menit, maka laju reaksi pada suhu 50◦C adalah …
- 1/2 menit
- 1/4 menit
- 1 menit
- 2 menit
- 4 menit
PEMBAHASAN :
Diketahui:
kenaikan suhu = 10 oC
kenaikan laju = 2x
T1 = 20 oC
T2 = 50 oC
Menentukan waktu reaksi saat 50 oC menggunakan rumusan:
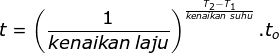
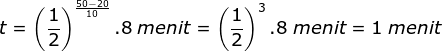
Jawaban C
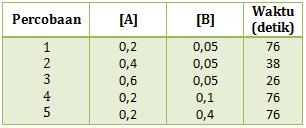
Dari data tersebut faktor yang mempengaruhi laju reaksi tersebut adalah …
- Waktu
- Konsentrasi
- Luas permukaan
- Luas permukaan & waktu
- Konsentrasi & suhu
PEMBAHASAN :
Dari data yang diperoleh dari tabel konsentrasi HCl dibuat tetap artinya tidak akan mempengaruhi laju reaksi. Sedangkan yang diubah adalah luas permukaan dalam bentuk serbuk, butiran dan kepingan yang menyebabkan perubahan terhadap waktu reaksi. Maka faktor yang mempengaruhi adalah luas permukaan
Jawaban C
- 5,4
- 7,2
- 9,6
- 18
- 36
PEMBAHASAN :
Untuk menentukan laju reaksi yang baru perlu mengetahui orde masing-masing pereaksi.
Menentukan orde A : cari 2 [B] yang sama (percobaan 1 dan 2)
![]()
![]()
![]()
x = 2
Menentukan orde B : cari 2 [A] yang sama (percobaan 1 dan 3)
![]()
![]()
![]()
y = 3
maka persamaan laju reaksinya adalah v = k[A]2[B]3
Untuk menentukan v saat [A] = 0,3 dan [B] = 0,4 maka ditentukan dari perbandingan dengan percobaan yang lain. Ambil percobaan 1
![]()
nilai k bisa di coret karena nilainya sama,maka:
![]()
v = 576 x 1,25 x 10-2 = 7,2
Jawaban B
Perlakuan apa saja yang tidak memberi pengaruh terhadap laju reaksi?
- Ukuran partikel- partikel pereaksi diperkecilkan
- Suhu di tingkatkan
- Konsentrasi pereaksi ditambahkan
- Volume pereaksi diperbesar
- Katalis ditambahkan kedalam reaksi
PEMBAHASAN :
Faktor-faktor yang mempengaruhi laju reaksi:
- Luas permukaan, jika ukuran partikel diperkecil maka luas permukaannya semakin besar semakin cepat bereaksi
- Suhu ditingkatkan menyebabkan energi kinetik zat meningkat sehingga reaksi semakin cepat.
- Konsentrasi pereaksi ditambah menyebabkan semakin banyak zat yang bertumbukan sehingga semakin cepat bereaksi.
- Katalis ditambahkan untuk menurunkan energi aktivasi sehingga reaksi semakin cepat.
Faktor yang tidak mempengaruhi yaitu volume pereaksi. Maka jawaban yang tepat adalah D
Jawaban D
- 4,8 x 10-2 s-1
- 3,6 x 10-2 s-1
- 3,2 x 10-2 s-1
- 2,4 x 10-2 s-1
- 1,6 x 10-2 s-1
PEMBAHASAN :
Menentukan laju pembentukan H2
![]()
Maka kita dapat menentukan laju penguraian PH3 melalui perbandingan dengan koefisien:
![]()
Saat [PH3] = 0,1 M maka nilai K
![]()
(tanda – artinya laju penguraian atau berkurang)
0,0016 M/s = k. (0,1 M)
![]()
Jawaban E
- 1 : 1
- 1 : 3
- 2 : 1
- 2 : 3
- 3 : 1
PEMBAHASAN :
Kita setarakan terlebih dahulu
2H2S(g) + SO2(g) → 3S(s) + 2H2O(l)
Laju reaksi masing-masing jika dibandingkan dengan koefisien masing-masing zat. Atau:
Perbandingan laju = perbandingan koefisien
maka jika ditanyakan perbandingan laju H2S dengan laju S maka tinggal dicari perbandingan koefisiennya, maka:
v H2S : v S = 2 : 3 (diambil dari koefisien H2S dan koefisien S)
Jawaban D
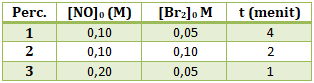
- r = k[NO]2
- r = k[Br2]
- r = k[NO][Br2]
- r = k[NO][Br2]2
- r = k[NO]2[Br2]
PEMBAHASAN :
Persamaan laju reaksi adalah hubungan antara laju reaksi dengan konsentrasi pereaksi, maka persamaan laju reaksinya:
r = k[NO]x[Br2]y
Menentukan orde reaksi NO (x)
Cari 2 [Br2] yang sama (percobaan 1 dan 3), lalu bandingkan [NO] di percobaan tersebut dengan t
![]()
(karena diketahui waktu bukan laju, dimana waktu berbanding terbalik dengan laju)
![]()
2x = 4
maka x = 2
Menentukan orde reaksi Br2 (y)
Cari 2 [NO] yang sama (percobaan 1 dan 2), lalu bandingkan [Br2] di percobaan tersebut dengan t
![]()
(karena diketahui waktu bukan laju, dimana waktu berbanding terbalik dengan laju)
![]()
2y = 2
maka y = 1
Maka persamaan laju reaksinya
r = k[NO]2[Br2]
Jawaban E
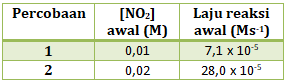
- 0,01 L mol-1 s-1
- 7,10 x 10-5 s-1
- 1,4 x 10-2 s-1
- 0,71 L mol-1 s-1
- 7,10 mol-1 s-1
PEMBAHASAN :
Reaksi di atas hanya memiliki 1 pereaksi saja yaitu NO2
maka persamaan laju reaksinya : v = k[NO2]x
Untuk menentukan orde NO2 (x) maka kita tinggal membandingkannya
![]()
2x = 4
maka x = 2
Menentukan k tinggal memasukan salah satu percobaan ke persamaan laju reaksi
v = k[NO2]2 (kita masukan percobaan 1)
7,1 x 10-5 = k (0,01)2
![]()
Jawaban D
- 0,01 M
- 0,05 M
- 0,10 M
- 0,15 M
- 0,20 M
PEMBAHASAN :
Reaksi jika menggunakan katalis NO2
2SO2(g) + O2(g) + NO2 → 2SO3(g) + NO2 (katalis akan dihasilkan kembali)
Reaksi jika menggunakan katalis NO2
2SO2(g) + O2(g) → 2SO3(g)
Jika kita bandingkan persamaan laju reaksi dengan NO2 dan tanpa NO2
![]()
Keadaan 2 adalah saat NO2 ditambahkan, Karena [SO2] dan [O2] sama maka dapat dicoret
![]()
![]()
Jawaban B
- laju reaksi (r) akan semakin cepat selama reaksi berlangsung
- laju reaksi (r) menjadi lebih cepat jika volume wadah diperbesar
- konsentrasi SO2 akan bertambah dengan laju sebesar r
- konsentrasi SO2Cl2 akan bertambah dengan laju sebesar r
- satuan konstanta laju reaksi (k) adalah M-1s-1
PEMBAHASAN :
Dari reaksi tersebut yang menjadi pereaksi adalah SO2Cl2, maka karena SO2Cl2 adalah pereaksi maka konsentrasinya akan berkurang bukan bertambah. Sedangkan SO2 sebagai produk maka konsentrasi akan bertambah karena koefisiennya sama dengan SO2Cl2 maka nilai lajunya sama dengan laju SO2Cl2 yaitu r. Karena orde 1 maka satuan konstanta laju reaksi adalah s-1. Volume berbanding terbalik dengan laju maka jika volume diperbesar laju semakin lambat. Laju belum tentu semakin cepat tergantung pada perlakuan pada reaksi. Maka jawaban yang paling benar adalah C
Jawaban C
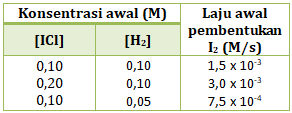
- r = k[ICl]2[H2]
- r = k[ICl]2[H2]2
- r = k[ICl][H2]2
- r = k[ICl][H2]
- r = k[ICl]2
PEMBAHASAN :
Persamaan laju reaksi adalah hubungan antara laju reaksi dengan konsentrasi pereaksi, maka persamaan laju reaksinya:
r = k[ICl]x[H2]y
Menentukan orde reaksi ICl (x)
Cari 2 [H2] yang sama (percobaan 1 dan 2), lalu bandingkan [ICl] di percobaan tersebut dengan v
![]()
![]()
2x = 2
maka x = 1
Menentukan orde reaksi H2 (y)
Cari 2 [ICl] yang sama (percobaan 1 dan 3), lalu bandingkan [H2] di percobaan tersebut dengan v
![]()
![]()
2y = 2
maka y = 1
Maka persamaan laju reaksinya
r = k[ICl][H2]
Jawaban D
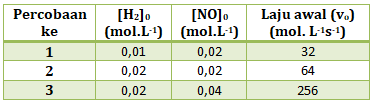
- 4 x 104
- 2 x 106
- 4 x 106
- 8 x 106
- 4 x 107
PEMBAHASAN :
Untuk menentukan K maka kita harus mengetahui persamaan laju reaksinya
Persamaan laju reaksi adalah hubungan antara laju reaksi dengan konsentrasi pereaksi, maka persamaan laju reaksinya:
v = k[H2]x[NO]y
Menentukan orde reaksi H2 (x)
Cari 2 [NO] yang sama (percobaan 1 dan 2), lalu bandingkan [H2] di percobaan tersebut dengan v
![]()
![]()
2x = 2
maka x = 1
Menentukan orde reaksi NO (y)
Cari 2 [H2] yang sama (percobaan 1 dan 3), lalu bandingkan [NO] di percobaan tersebut dengan v
![]()
![]()
2y = 4
maka y = 2
Maka persamaan laju reaksinya
v = k[H2][NO]2
Untuk menentukan nilai K, maka masukan salah satu percobaan
v1 = k[H2]1[NO]12
32 = k. (0,01)(0,02)2
![]()
Jawaban D
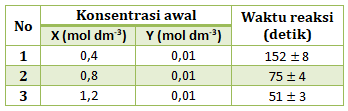
- nol
- setengah
- satu
- dua
- tiga
PEMBAHASAN :
Menentukan orde reaksi X
Cari 2 [Y] yang sama (percobaan 1 dan 2), lalu bandingkan [X] di percobaan tersebut dengan t
![]()
(karena diketahui waktu bukan laju, dimana waktu berbanding terbalik dengan laju)
- 8 kali
- 1/16 kali
- 16 kali
- 32 kali
- 1/32 kali
PEMBAHASAN :
Sebelum perubahan volume persamaan laju reaksinya
r1 = k[NO]2[O2]
maka setelah diubah volumenya
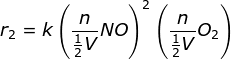
maka r2 = 8 r1 atau 8 kalinya laju mula-mula
Jawaban A